Histiocitose
- 8 de fev. de 2024
- 11 min de leitura
Criança de 4 anos apresentando dor cervical após andar de bicicleta. Mãe inicialmente interpretou como torcicolo, mas como não teve melhora procurou atendimento médico. Solicitadas radiografias e, posteriormente, tomografia computadorizada (TC) e ressonância magnética (RM) da coluna cervical.

Figura 1 (a-b): Radiografias da coluna cervical nas incidências anteroposterior (1a) e perfil (1b).

Figura 2 (a-d): Reconstrução tomográfica da coluna vertebral com a técnica MPR no plano sagital.

Figura 3 (a-d): Reconstrução tomográfica da coluna cervical com a técnica MPR no plano sagital.

Figura 4 (a-c): Reconstrução tomográfica da coluna vertebral com a técnica MPR no plano coronal.

Figura 5 (a-c): Reconstrução tomográfica da coluna cervical com a técnica MPR no plano coronal.
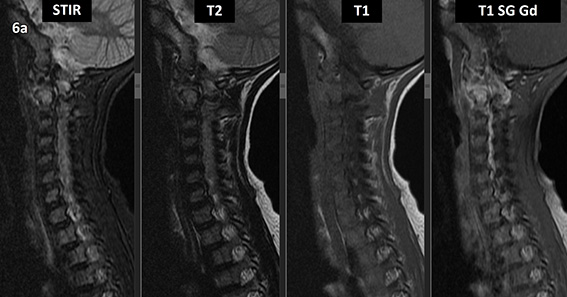
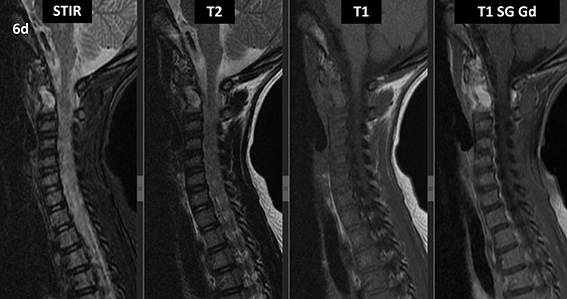
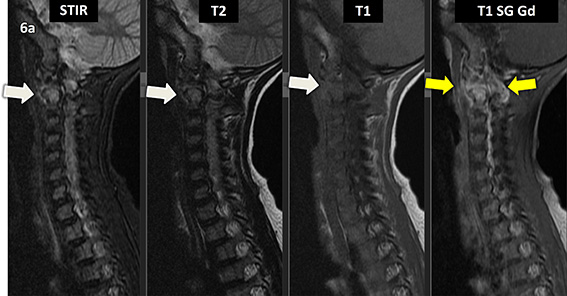
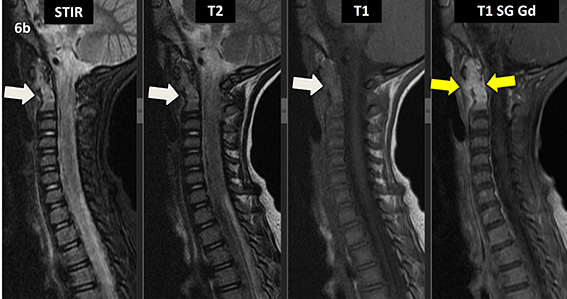
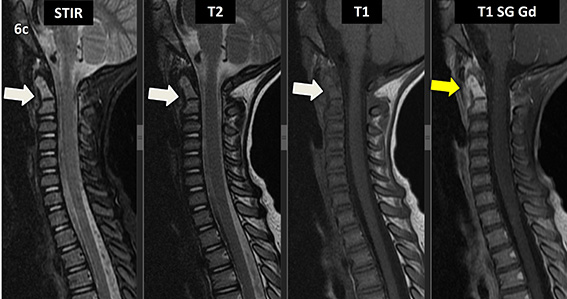
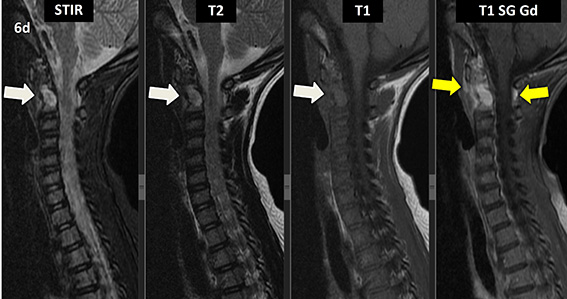
Figura 6 (a-d): Imagens consecutivas de RM da coluna cervical no plano sagital nas ponderações STIR, T2, T1 e T1 com supressão de gordura após administração de meio de contraste (T1 SG Gd+).

Figura 7 (a-c)': Imagens consecutivas de RM da coluna cervical no plano transversal na ponderação T2 mostrando a alteração do sinal no corpo de C2 (setas). À direita imagem no plano sagital para identificação do nível estudado.
Descrição dos achados

Figura 1 (a-b)’: Radiografias da coluna cervical nas incidências anteroposterior (1a) e perfil (1b), onde há indefinição parcial de C2 (seta), porém a caracterização da alteração é difícil no RX, sendo indicado prosseguir a investigação com outros métodos de imagem nesse caso.

Figura 2 (a-d)’: Reconstrução tomográfica da coluna vertebral com a técnica MPR no plano sagital mostrando fragmentação do corpo vertebral C2 (setas) com os outros corpos vertebrais com aspecto normal.

Figura 3 (a-d)’: Reconstrução tomográfica da coluna cervical com a técnica MPR no plano sagital mostrando melhor a fragmentação do corpo vertebral C2 (setas), secundária a lesão lítica com interrupção cortical mais evidente na margem posterior da vértebra.

Figura 4 (a-c)’: Reconstrução tomográfica da coluna vertebral com a técnica MPR no plano coronal mostrando fragmentação do corpo vertebral C2 (setas) com os outros corpos vertebrais com aspecto normal.

Figura 5 (a-c)’: Reconstrução tomográfica da coluna cervical com a técnica MPR no plano coronal mostrando melhor a lesão lítica com interrupção cortical no corpo vertebral C2 (setas).
Figura 6 (a-d)’: Imagens consecutivas de RM da coluna cervical no plano sagital nas ponderações STIR, T2, T1 e T1 com supressão de gordura após administração de meio de contraste (T1 SG Gd+) mostrando a alteração do sinal do corpo de C2, que apresenta alto sinal em STIR e T2 e sinal intermediário em T1 (setas brancas), com realce pelo contraste, inclusive no seu arco posterior (setas amarelas).

Figura 7 (a-c)’: Imagens consecutivas de RM da coluna cervical no plano transversal na ponderação T2 mostrando a alteração do sinal no corpo de C2 (setas). À direita imagem no plano sagital para identificação do nível estudado.
Discussão
“Histiócito” é o termo usado no passado para descrever as células mononucleares fagocíticas, sendo as histiocitoses um grupo de doenças raras caracterizadas pelo acúmulo patológico de células derivadas dos monócitos, macrófagos e de linhagem dendrítica.
As primeiras descrições dessa doença remontam ao início dos anos 1900 porque a HCL pode produzir síndromes clínicas distintas, historicamente descritas como granuloma eosinofílico, doença de Hand–Schüller–Christian (lesões ósseas granulomatosas eosinofílicas líticas, diabetes insipidus e exoftalmia em crianças) e doença de Letterer–Siwe (doença sistêmica agressiva e fatal com infiltração da medula óssea, pele, fígado e baço por células reticuloendoteliais). Posteriormente, Farber e Lichtenstein identificaram que biópsias de casos fatais da doença de Letterer–Siwe e do granuloma eosinofílico eram indistinguíveis entre si, levantando a hipótese de tratar-se de uma mesma doença, sendo proposto o termo “histiocitose X”, em que o ‘X’ indicava uma célula de origem incerta, que após o surgimento da microscopia eletrônica foi caracterizada com uma célula de Langerhans epidérmica disfuncional, renomeando a “histiocitose X” para histiocitose de células de Langerhans. A célula de Langerhans já havia sido descrita por Paul Langerhans em 1868 como uma célula com dentritos característicos que representa 1% das células epidérmicas. Como essas síndromes podem ter manifestações variadas da mesma doença de base e como a maioria dos pacientes com HCL tem manifestações de mais de uma dessas síndromes, as designações distintas das síndromes (exceto para granuloma eosinofílico) agora têm muito mais significado histórico.
A histiocitose das células de Langerhans (HCL) é a histiocitose mais comum, em que há proliferação ou diferenciação aberrante de células dendríticas (células apresentadoras de antígenos) do sistema mononuclear fagocítico.
Na HCL as células dendríticas anormalmente proliferativas infiltram-se em um ou mais órgãos acarretando lesões granulomatosas compostas por histiócitos e infiltrado inflamatório que podem virtualmente ocorrer em qualquer órgão, embora exista uma predominância no acometimento ósseo, da pele, pulmões e sistema endócrino (principalmente a hipófise), além do fígado, baço e linfonodos.
Os órgãos podem ser afetados por infiltração, causando disfunção, ou por compressão das estruturas adjacentes aumentadas. Em torno de metade dos pacientes há envolvimento de múltiplos órgãos. Existe uma tendência de subdividir a HCL em 3 grandes grupos:
Unifocal – lesão óssea solitária, grupo onde se enquadra o granuloma eosinofílico
Multifocal unissistêmico
Multifocal multissistêmico
Os sistemas mais comumente envolvidos na HCL são o esqueleto, a pele e o sistema nervoso central.
A prevalência de HCL é bastante variável (de cerca de 1:50.000 a 1:200.000), com incidência estimada de 5 a 8 casos por milhão de crianças com idade inferior a 15 anos. Há leve predomínio no sexo feminino, com razão masculino:feminino de cerca de 1,2:1,6. A incidência em adultos é de cerca de 1 a 2 casos por milhão de pessoas, mas acredita-se que essa incidência seja subestimada. Mutações são identificadas em 50 a 60% dos pacientes com HCL e cerca de 10 a 15% dos pacientes têm mutações que levantam a discussão se a HCL é uma doença primariamente neoplásica de linhagem mieloide causado por oncogenes, se é uma decorrente de desregulação do sistema imune ou uma combinação de ambas. O aspecto histológico benigno das células mononucleares acompanhadas de infiltrado inflamatório em associação com a cascata inflamatória sistêmica suportam a etiologia inflamatória da HCL, enquanto as mutações compartilhadas com os percussores das células hematopoiéticas falam a favor da HCL se tratar de uma neoplasia mieloide similar ao linfoma de Hodgkin pediátrico.
A HCL tem diferentes formas de apresentação, variando desde lesão única de início indolente até início explosivo de doença multissistêmica.
O diagnóstico baseia-se na biópsia, que demonstra a infiltração anormal das células de Langerhans em associação com células inflamatórias (linfócitos T, eosinófilos, macrófagos e células gigantes multinucleadas), mas é importante reconhecer as formas de apresentação da histiocitose nos métodos de imagem para ajudar o médico assistente no direcionamento propedêutico.
Cerca de 80% dos pacientes com HCL apresentam acometimento ósseo, o que faz com que o RX seja o exame inicial que irá determinar quais outros exames podem ser necessários e, em muitos casos, o aspecto radiográfico já indica a necessidade de biópsia.
Os locais mais comuns de acometimento ósseo na HCL são os ossos do crânio, coluna, membros e bacia, sendo a mesma localização das lesões do mieloma múltiplo.
Estima-se que a coluna vertebral esteja envolvida em 6,5 a 20% dos pacientes com HCL, sendo que coluna torácica costuma estar envolvida em 54% dos casos, seguida pela coluna lombar (35% dos casos) e pela coluna cervical (11% dos casos).
Em crianças, alguns achados são considerados sugestivos de histiocitose, como a vértebra plana (também denominada vértebra “em hóstia” ou vértebra “em panqueca”), caracterizada por acentuada redução uniforme da altura do corpo vertebral, sem acometer o arco posterior, que pode ter resolução espontânea (figura 8):

Figura 8 (a-e): Imagens radiográficas em perfil da transição toracolombar de criança de 3 anos com história de dor há 3 semanas e ao exame físico apresentando desconforto à palpação da coluna lombar superior. Inicialmente foi identificada acentuada redução da altura do corpo vertebral lombar (seta branca), que evoluiu para vértebra plana (seta amarela), que nos exames de controle teve a altura progressivamente restaurada (setas azuis). Modificado de N Engl J Med 2012; 10: 366:e30.
Entretanto, a vértebra plana é uma condição rara que não é patognomônica da histiocitose, podendo ocorrer em outras condições oncológicas e não oncológicas. Para facilitar a memorização, foi criado o mnemônico em inglês HEIGHT OF HOMO:
H – Histiocitose
E – Ewing (sarcoma de)
I – Infecção
G – Gigante, do tumor de células Gigantes (TCG)
H – Hematológico (tumores)
T – Tuberculose
O – Osteogênese imperfeita
F – Fratura
H – Hemangioma
O – Osteoblastoma
M – Metástases
O – Osteomielite crônica
Pela localização e faixa etária acometida, os principais diagnósticos diferenciais da HCL são infecção (em especial a tuberculose) e neoplasias malignas (como sarcoma de Ewing e neoplasias hematológicas).
A real incidência de acometimento da região atlantoaxial não é bem definida, mas é importante seu reconhecimento pelo risco de deslocamento e de compressão da medula espinhal alta. No caso do acometimento atlantoaxial, que pode ser apenas do atlas, do axis (que pode ser apenas do processo odontoide ou do corpo) ou de C1 e C2, o padrão de destruição óssea tem sido bastante variável na literatura, como relatos de lesão óssea geográfica, com margens bem definidas, mal definidas e em roído de traça. Margens escleróticas foram encontradas em 22% dos casos e destruição cortical em 71% dos pacientes, podendo também ser observado fraturas compressivas das massas laterais do atlas ou do corpo de C2. Mal alinhamento atlantoaxial pode ser identificado como assimetria na distância entre o processo odontoide e as massas laterais de C1 ou como deslocamento anterior.
O aspecto radiográfico típico da HCL é o de uma lesão lítica focal, bem definida, recortada e com aspecto de “perfuração” (“punched-out), que pode evoluir com halo de esclerose e reação periosteal. Há predomínio do acometimento do esqueleto axial, com mais de 50% dos casos ocorrendo nos ossos chatos, como calota craniana, costelas e cintura pélvica.
Uma forma de apresentação bastante sugestiva, embora também não patognomônica, é a de lesão lítica isolada na calota craniana (figura 9). Os ossos parietal e frontal são os mais comumente acometidos, sendo mais comum o acometimento da calota craniana em comparação com os ossos da base do crânio.

Figura 9: Lesão lítica isolada na calota craniana (seta) típica da histiocitose, recortada, com limites bem definidos e fino halo de esclerose. Modificado de Niknejad M, Langerhans cell histiocytosis. Case study, Radiopaedia.org, https://doi.org/10.53347/rID-61238
Uma característica das lesões na calota craniana é o acometimento concomitante das tábuas interna e externa, com formação do “sequestro em botão”, que seria um fragmento de osso residual de permeio à lesão lítica (figura 10).

Figura 10 (a-c): Radiografia da calota craniana (10a) mostrando o “sequestro em botão” (seta branca), representando fragmento ósseo residual de permeio à lesão lítica da histiocitose. Modificado de https://pubs.rsna.org/doi/abs/10.1148/92.5.969?journalCode=radiology. Nas imagens tomográficas de outros pacientes (10b e 10c) é possível identificar nas lesões da histiocitose o acometimento das tábuas interna e externa e os fragmentos ósseos residuais de permeio (setas amarelas). Modificado de Radiology Case Reports Volume 14, Issue 12, December 2019, Pages 1478-1482.
No caso de acometimento dos ossos longos há predileção pela metáfise, sendo o fêmur o osso mais frequentemente acometido, seguido pelo úmero e tíbia.
Alguns autores preconizam a utilização de radiografia panorâmica do esqueleto com baixa dose em posição ortostática na incidência anteroposterior como rastreio de lesões ósseas em crianças (figura 11), devendo ser ressaltado que a sensibilidade do RX é limitada, uma vez que lesões líticas são aparentes apenas quando há perda de 30 a 50% da densidade mineral óssea e a sobreposição das estruturas pode prejudicar a detecção das lesões.

Figura (11): Radiografia panorâmica do esqueleto com baixa dose na incidência anteroposterior preconizada por Khung et al., onde foram identificadas lesões líticas bem delimitadas na calota craniana, metáfise proximal do úmero e no colo do fêmur (setas). Modificado de Insights Imaging (2013) 4:569–579.
A ultrassonografia (USG), tomografia computadorizada (TC) e a ressonância magnética (RM) podem ser indicadas para exclusão de doença sistêmica, com acometimento pulmonar, abdominal e linfonodal, e detecção de complicações das lesões ósseas, como colapsos vertebrais e compressão medular e acometimento neurológico.
Um sinal descrito nas lesões líticas da histiocitose é o aspecto em “brotamento” decorrente do recorte endosteal, mais bem caracterizado nas imagens tomográficas (figura 12).

Figura 12 (a-c): Tomografia computadorizada no plano coronal do quadril esquerdo de criança com histiocitose (12a) que apresenta lesões líticas bem definidas no acetábulo (seta amarela) e no colo e diáfise proximal do fêmur (setas vermelhas), onde se observa o aspecto em “brotamento” (setas brancas) - modificado de Insights Imaging (2013) 4:569–579. Em 12b representação esquemática do aspecto em brotamento (setas) no osso longo, decorrente do recorte endosteal ocasionado pela lesão lítica localizada no canal medular que se estende à córtex, numa alusão aos brotos identificados no tronco das plantas (12c).
Embora o aspecto de lesão lítica isolada de limites bem definidos, recorte endosteal e halo de esclerose seja típico, nem toda lesão óssea tem esse aspecto, com algumas lesões apresentando limites mal definidos (figura 13), uma vez que a forma de apresentação depende do osso acometido e da fase da doença.

Figura 13 (a-b): Radiografias do fêmur de outros pacientes com histiocitose mostrando lesões líticas isoladas na diáfise femoral de limites mal definidos. No primeiro caso (13a) a lesão (seta branca) não apresenta halo de esclerose ou recorte endosteal expressivo. No outro caso (13b) há o aspecto em brotamento (seta amarela) em associação com reação periosteal (setas vermelhas). Modificado de Insights Imaging (2013) 4:569–579.
Pode também ser encontrada reação periosteal em associação com as lesões ósseas, que costuma apresentar apenas uma camada. No quadro 1 estão resumidas as principais características das lesões ósseas na histiocitose.

Quadro 1: Resumo das principais características das lesões ósseas na histiocitose.
O sinal das lesões da HCL na RM pode ser bastante variável, desde iso a hiperintenso ou heterogêneo tanto em T1 quanto em T2, com realce discreto, moderado ou intenso pelo meio de contraste, tendo sido descrito também padrão semelhante ao encontrado no cisto ósseo aneurismático, com múltiplas lojas com nível líquido-líquido. É frequente haver edema ósseo ao redor da lesão.
A RM de corpo inteiro tem surgido como uma alternativa ao inventário ósseo radiográfico, com a vantagem de identificar outras alterações, como hepatomegalia e esplenomegalia, sem o risco de radiação ionizante.
O PET/CT com uso do FDG pode ajudar na detecção de histiócitos metabolicamente ativos e de lesões ósseas e extra-ósseas que podem não ser detectadas nos demais métodos de imagem, principalmente nos estágios iniciais da doença e na avaliação da resposta terapêutica (figura 14).

Figura 14 (a-b): Imagens de PET-CT mostrando discreta imagem lítica na margem anterior do corpo vertebral (seta amarela), que apresentou hipercaptação pelo FDG. Modificado de Hell J Nucl Med 2023; 26(3): 215-218.
As lesões ósseas, assim como a vértebra plana, podem ter resolução espontânea, com reossificação da lesão, deixando pouca ou nenhuma deformidade residual, conforme visto na figura 8.
A base do tratamento da HCL é com drogas quimioterápicas e prednisona, sendo que a resposta e tolerância ao tratamento são melhores na criança em comparação com os adultos.
O prognóstico é bom para os pacientes com doença restrita à pele, aos linfonodos ou aos ossos e idade > 2 anos. Os indicadores de prognóstico desfavorável são idade < 2 anos e doença disseminada, particularmente comprometendo sistema hematopoético, fígado, baço ou sua combinação, sendo esses casos, sendo classificados como HCL de alto risco pela alta taxa de mortalidade e taxas de cura com uso dos protocolos padrão de quimioterapia inferiores a 50%. Além disso, entre os pacientes presumidamente curáveis há risco de desenvolvimento tardio de síndromes neurodegenerativas com consequências devastadoras.
O comprometimento dos ossos zigomático, esfenoidal, orbital, etmoidal ou temporal denota uma categoria de risco de lesão no sistema nervoso central que confere maior risco de doença neurodegenerativa do crânio e na parte anterior da face.

Leitura sugerida
Mo JT, Darrow MA, Sharma JD. Langerhans cell histiocytosis with aneurysmal bone cyst-like changes: a case-based literature review. Childs Nerv Syst. 2023 Nov;39(11):3057-3064. doi: 10.1007/s00381-023-06108-7. Epub 2023 Jul 31. PMID: 37522932; PMCID: PMC10643349.
Sevaslidou I, Papavasileiou P, Gavra M, Baka M, Polychronopoulou S, Gogou L. The role of 18F-FDG PET/CT imaging in paediatric Langerhans disease: Case report. Hell J Nucl Med. 2023 Sep-Dec;26(3):215-218. doi: 10.1967/s002449912611. PMID: 38149775.
Angelini A, Mosele N, Gnassi A, Baracco R, Rodà MG, Cerchiaro M, Ruggieri P. Vertebra Plana: A Narrative Clinical and Imaging Overview among Possible Differential Diagnoses. Diagnostics (Basel). 2023 Apr 17;13(8):1438. doi: 10.3390/diagnostics13081438. PMID: 37189540; PMCID: PMC10137469.
Samara A, Nepute J, Lu HC, Perrin RJ, Eldaya RW. Calvarial Langerhans cell histiocytosis in an Adult: Typical imaging findings in an atypical age group. Radiol Case Rep. 2019 Oct 9;14(12):1478-1482. doi: 10.1016/j.radcr.2019.09.009. PMID: 31641396; PMCID: PMC6796621.
Allen CE, Merad M, McClain KL. Langerhans-Cell Histiocytosis. N Engl J Med. 2018 Aug 30;379(9):856-868. doi: 10.1056/NEJMra1607548. PMID: 30157397; PMCID: PMC6334777.
Krooks J, Minkov M, Weatherall AG. Langerhans cell histiocytosis in children: History, classification, pathobiology, clinical manifestations, and prognosis. J Am Acad Dermatol. 2018 Jun;78(6):1035-1044. doi: 10.1016/j.jaad.2017.05.059. PMID: 29754885.
Zhang L, Jiang L, Yuan H, Liu Z, Liu X. Atlantoaxial Langerhans cell histiocytosis radiographic characteristics and corresponding prognosis analysis. J Craniovertebr Junction Spine. 2017 Jul-Sep;8(3):199-204. doi: 10.4103/jcvjs.JCVJS_21_16. PMID: 29021671; PMCID: PMC5634106.














Comentários